|
Какой рейтинг вас больше интересует?
|
Причины акалькулезного холецистита2012-09-25 16:06:00+ развернуть текст сохранённая копия
Тэги: гастроэнтерология, статья Кровотечение из варикознорасширеных вен пищевода2012-09-25 15:53:00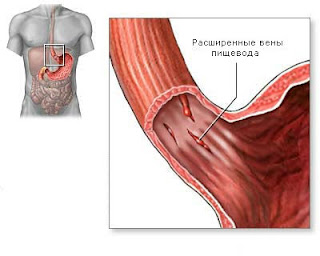 Кровотечение из варикознорасширеных вен пищевода считаются одним из самых драматических осложнений портальной гипертензии. Из-за значительного прогресса в медицине заболеваемость и смертность от кровотечения из варикознорасширеных вен уменьшились за последние десятилетия. Тем не менее, каждый эпизод кровотечения все еще несет риск смертности на 20%. Таким образом, отбор пациентов большого риска кровотечения и профилактическое лечение лиц с крупными варикознорасширеными венами является стандартом в случае цирроза печени. В этой связи, первичная профилактика определяется как профилактическое лечение в целях предотвращения первого эпизода кровотечения у пациентов с варикозно расширеными венами, в то время как предпервичная профилактика - профилактическое лечение пациентов с циррозом без варикознорасширеных вен, направленное на предупреждение их развития. Наиболее значимыми факторами риска для возникновения кровотечения из варикознорасширеных вен являются размер и давление на стенки варикознорасширеных вен, а также портальное давления. Поскольку размер и напряженность стенок зависят от увеличения портального давления, этот параметр, как правило, расценивается как градиент венозного давления печени (HVPG) и, возможно, является наиболее важным показателем, предсказывающим развитие и разрыв варикознорасширеных вен: пока HVPG ниже 10 мм Hg, варикозное расширение вен пищевода не происходит. Кроме того, сокращение HVPG ниже 12 мм ртутного столба значительно снижает риск первого кровотечения из варикознорасширеных вен. Два профилактических подхода в настоящее время рассматривают эти параметры: фармакологическое уменьшение портального давления бета-блокаторами может препятствовать развитию, росту и разрыву варикознорасширеных вен. Кроме того, местная облитерация варикознорасширеных вен пищевода с помощью эндоскопического лигирования успешно используется для предотвращения кровотечения у пациентов с крупными варикознорасширеными венами. Поскольку другие варианты лечения, такие как шунтирование и эндоскопическая склеротерапия, уже не используют, в данной статье будет рассмотрено профилактическое лечение препаратами и эндоскопическое лигирование. Скрининг эндоскопия Имеют место многочисленные попытки предсказать наличие или отсутствие варикознорасширеных вен пищевода по клиническим или лабораторным анализам (например, количеству тромбоцитов, спленомегалии). Ни одну из этих моделей нельзя считать достаточно точной. Таким образом, всем пациентам должна быть проведена ФГДС для выявления варикозного расширения вен пищевода при установлении диагноза цирроза печени . Согласно последним данным из национальной эндоскопической базы данных Соединенных Штатов половина пациентов с циррозом, которым была проведена эндоскопия, имеет варикознорасширеные вены. У этих больных должна проводиться первичная профилактика кровотечения из варикознорасширеных вен, в то время как остальная половина может быть кандидатами на проведение предпервичной профилактики. Предпервичная профилактика. К терапевтическим подходам предпервичной профилактики относится постоянное введение неселективных бета-блокаторов. Эти лекарства снижают портальное давление примерно на 15 - 20%. и, возможно, предотвратить или задержать развитие варикозного расширения вен и соответственно уменьшить риск кровотечения. Два рандомизированных двойных слепых многоцентровых исследований были опубликованы по этой теме. Первое исследование включало 206 больных с циррозом с мелкими варикознорасширеными венами (N = 127) и их отсутствие (N = 79). 102 пациента получали фиксированные дозы пропранолола длительного действия (160 мг / сут) и находились под наблюдением в течение двух лет. Риск кровотечения и риск общей смертности не различались между группами, получающими лечение. Примечательно, что через два года доля пациентов с крупными варикознорасширеными венами была выше в группе пропранолола, чем в группе плацебо. Несмотря на некоторые методологические аспекты, включая высокий уровень отбора, ограничивают значение этих результатов. Очевидно, что этот процесс не поддерживается профилактическим введением бета-блокаторов у больных с циррозом с мелкими варикознорасширеными венами или их отсутствием. В более позднем двойном слепом многоцентровом исследовании, Groszmann и др.. включили 213 пациентов с циррозом без варикознорасширеных вен. Пациенты были рандомизированы и получали либо плацебо, либо неселективный бета-блокатор тимолол. Доза тимолола была скорректирована до сокращения сердечного ритма на 25%. Основной конечной точкой было предупреждение варикозного расширения вен или кровотечения из варикознорасширеных вен. В течение последующих 4 лет никаких различий между группами не было отмечено. Важно отметить, что серьезные неблагоприятные события произошли у 18% пациентов, получавших тимолол, по сравнению с 6% в группе плацебо. В заключение можно отметить, что имеющиеся данные свидетельствуют о том, что бета-блокаторы не являются полезными для предотвращения формирования варикознорасширеных вен у пациентов с циррозом. Таким образом, предпервичная профилактика у пациентов с циррозом без варикознорасширеных вен не указана. Первичная профилактика. Многие плацебо-контролируемые исследования и три мета-анализа четко показали, что неселективные бета-блокаторы эффективно снижают риск первого кровотечения у пациентов с крупными варикознорасширеными венами: у нелеченных пациентов с крупными варикознорасширеными венами (обычно определяется как вены с диаметром> 5 мм) риск кровотечений составляет примерно 30% по сравнению с 15% у пациентов, получающих лечение бета-блокаторами . Кроме того, профилактическое применение бета- блокаторов снижает общую смертность у пациентов повышенного риска на 20% . Таким образом, неселективные бета-блокаторы были основой первичной профилактики кровотечения из варикознорасширеных вен в течение последних 15 лет. Для того чтобы достичь желаемого эффекта на уровень портального давления необходимо подобрать достаточную дозу препарата: средняя ежедневная доза пропранолола для первичной профилактики составляет от 80 до 100 мг по данным недавних исследований. Поэтому мы рекомендуем начинать с дозировки 40 мг пропранолола. Несмотря на то, что ритм сердечных сокращений не коррелирует с портальным давлением, он должен контролироваться, поскольку доза бета-блокатор, которая уменьшает сердечный ритм более чем на 25% будет часто вызывать побочные эффекты. После профилактического лечения бета-блокаторами, прием препаратов должен быть продолжен, поскольку риск кровотечения вновь быстро возрастает после их отмены. Тем не менее, многие пациенты имеют противопоказания к лечению бета-блокаторами или не могут принимать эти лекарства в адекватной дозе. Что касается медикаментозного лечения, из многих других препаратов, которые были оценены, ни один окончательно не доказал свою эффективность. Нитраты, как отдельно, так и в комбинации с бета-блокаторами не рекомендованны для первичной профилактики кровотечения из варикознорасширеных вен : в исследовании , сравнивающем ISMN с плацебо, у пациентов с непереносимостью бета-блокаторов не было найдено положительного эффекта в профилактике кровотечения. Сочетание лечения (ISMN и бета-блокатор) не является более эффективным, чем монотерапия бета-блокаторами . Несмотря на первоначальный энтузиазм докладов, гемодинамические исследования антагонистов рецепторов ангиотензина II также вызывают разочарование. Таким образом, препаратами первичной профилактики кровотечения из варикознорасширеных вен являются только неселективные бета-блокаторы. За последние десять лет, профилактическое эндоскопическое лигирование крупных варикознорасширеных вен было создано в качестве альтернативы лечения бета-блокаторами. По данным мета-анализа пяти статистически однородных исследований польза профилактического лигирования выше неактивного лечения. Хотя одно исследование, которое сравнивало лигирование и неактивное лечение у пациентов, которые не могут переносить бета-блокаторы, не смогло продемонстрировать пользу профилактического лигирования. В соответствии с действующим консенсусом лигирование должны быть предложено пациентам, которым противопоказаны бета-блокаторы или имеют непереносимость, а также крупные варикознорасширеные вены . По-прежнему вызывает дискуссии, должны ли быть использованы бета-блокаторы или лигирование в качестве первого выбора первичной профилактики. Совсем недавно систематический обзор, включающий шестнадцать исследований по сравнению бета-блокаторов и лигирования для первичной профилактики кровотечения . В 15 из 16 исследований были включены только пациенты с крупными варикознорасширеными венами. Лишь в трех исследованиях было сообщено об адекватном контроле. Разницы в смертности и риске кровотечений в группах бета-блокаторов и лигирования не было найдено. В отличие от этого, исследования с неясным контролем обнаружили, что лигирование является более эффективным, чем бета-блокаторы. Итак, изучив данные комплексно был сделан вывод, что лигирование не превосходит лечение бета-блокаторами для первичной профилактики кровотечения у пациентов с крупными варикознорасширеными венами. Лечение бета-блокаторами, безусловно, дешевле, чем эндоскопическое лечение, поэтому мы по-прежнему предпочитаем пропранолол в качестве первого выбора для лечения этих больных. Больные с мелкими варикознорасширеными венами. Лишь очень немногие данные о профилактическом лечении пациентов с мелкими варикознорасширеными венами были опубликованы до сих пор. В отличие от вышеупомянутого судебного исследования Cales и др.., Меркель и др.. продемонстрировали пользу профилактического лечения бета-блокаторами больных с мелкими варикознорасширеными венами. Эти исследователи изучили 161 пациентов с циррозом и мелкими варикознорасширеными венами, получающих плацебо или лечение надололом. Риск роста варикознорасширеных вен и кровотечений из них был значительно ниже в группе надолола. Однако в этом исследовании только у двух пациентов возникло кровотечение перед тем как варикознорасширеные вены выросли из небольших до крупных. В целом, профилактическое введение бета-блокаторов не может быть рекомендовано в качестве стандартного лечения больных с мелкими варикознорасширеными венами, но может быть особенно полезно для пациентов, у которых имеется высокий риск кровотечений (например, класс C по Child). Тэги: врач, гастроэнтерология, статья Гастрит: симптомы и лечение2012-09-25 12:08:00... как правило, гастроэнтерологом). гастроэнтерологу, доктору, ...
+ развернуть текст сохранённая копия Тэги: гастроэнтерология, статья Гепаторенальный синдром2012-09-21 16:28:00 Гепаторенальный синдром (HRS) является потенциально обратимой причиной почечной недостаточности, которая возникает у пациентов с циррозом, асцитом, а также у больных с о. печеночной недостаточностью либо алкогольным гепатитом. Он характеризуется нарушениями функции почек, вызванными изменениями сердечно-сосудистой сис-мы, чрезмерной активностью в симпатической нервной системе и ренин-ангиотензиновой системе, что приводит к тяжелой почечной вазоконстрикции со снижением уровня клубочковой фильтрации (КФ). Лица с гепаторенальным синдромом в большинстве случаев имеют конечные стадии болезни печени (MELD) и высокие баллы по шкале Чайлд-Пью с низким артериальным давлением, низким содержанием натрия в сыворотке и задерживанием натрия с мочой. Креатинин сыворотки повышается и определяет HRS, но он, как правило, ниже, чем у больных о. почечной недостаточностью без цирроза, в связи с сокращением мышечной массы и низким эндогенным производством креатинина при циррозе. Есть 2 типа гепаторенального синдрома, как ранее было определено Международным клубом асцита. При типе 1 HRS почечная функция стремительно ухудшается с увеличением сывороточного креатинина более 2,5мг/дл меньше, чем за 2 недели. Этот тип HRS, если он не лечится, связан с очень плохим прогнозом с медианой времени выживаемости 2 недели. Тип 2 гепаторенального синдрома характеризуется постоянным ухудшением функции почек и уровня сыв. креатинина, который, как правило, колеблется 1,5-2,5 мг / дл. Большинство больных с типом 2 гепаторенального синдрома имеют выживаемость 6 месяцев, если нет трансплантации. Тип 1 гепаторенального синдрома может развиваться стихийно, но во многих случаях она вызвана бактериальными инфекциями, такими как, например, спонтанный бактериальный перитонит (СБП) или сепсис, о. алкогольным гепатитом, а также объемным парацентезом без введения альбумина. Бактериальные инфекции и СБП связаны с типом 1 гепаторенального синдрома примерно в 30-33% случаев. Объемный парацентез (> 5 литров) без введения альбумина может вызвать развитие типа 1 гепаторенального синдрома почти в 15-20% случаев. Почечная недостаточность может возникнуть у 10% больных с циррозом с желудочно-кишечными кровотечениями, но в большинстве случаев это объясняется о. тубулярным некрозом, а не гепаторенальным синдромом. Патогенез Основной характеристикой гепаторенального синдрома является наличие почечной вазоконстрикции. Эта вазоконстрикция происходит у пациентов на конечных стадиях цирроза и асцита, являясь следствием непрерывного процесса, включающего несколько механизмов, в том числе системных изменений в артериальном кровообращении, увеличении портального давления, нарушении сердечной функции, активации системных и почечных вазоконстрикторных факторов, которые действуют на почечную циркуляцию и приводят к почечной недостаточности (функциональной) без гистологического повреждения почек. Подробный обзор патогенеза гепаторенального синдрома при циррозе может быть найден в другом обзоре. Клинические признаки и диагностика. Нет каких-либо специфических клинических признаков HRS. Большинство пациентов имеют особенности, характерные для основных заболеваний печени с гипербилирубинемией, повышенным протромбиновым временем, тромбоцитопенией, печеночной энцефалопатией, гипоальбуминемией, а также объемным асцитом. Кроме того пациенты имеют низкое артериальное давление и снижение системного сосудистого сопротивления. Почечная недостаточность при HRS часто, но не всегда, связана с серьезной олигурией (объем мочи <500 мл/24 часов), задержкой натрия с мочой (<10 meq / L натрий мочи), и гипонатриемией (натрий в сыворотке <130 мг-экв / л). Диагностика гепаторенального синдрома основывается на конкретных клинических критериях, которые направлены на исключение других этиологич. причин возникновения почечной недостаточности, которые не являются функциональными. Предлагаемые диагностические критерии были недавно пересмотрены Международным клубом асцита. Эти критерии несколько отличаются от ранее определенных в 1996 году критериев. Основные различия заключаются в том, что : 1 / Почечная недостаточность с постоянной бактериальной инфекцией, но в отсутствие септического шока, считается гепаторенальным с-мом, 2 / Введение плазмы должны выполняться с альбумином, а не физиологическим раствором, 3 / Малые диагностические критерии были сняты, поскольку они имели малое диагностическое значение для гепаторенального синдрома. Наиболее распространенные этиологические причины возникновения почечной недостаточности при циррозе, которые должны быть исключены до проведения диагностики гепаторенального синдрома, включают преренальную почечную недостаточность, о. тубулярный некроз вторичный к шоку, лекарственную почечную недостаточность (в основном, не из-за НПВС или аминогликозидов) и гломерулопатии у пациентов с вирусным гепатитом или алкогольным гепатитом. Предупреждение У пациентов с СПР внутривенное введение альбумина (доза -1,5 г / кг - диагностика инфекции, 1 г / кг по истечению 48 часов) предотвращает развитие гепаторенального с-ма, поскольку это препятствует повышению артериальной органной вазодилятации, вызванной инфекцией, которая еще больше сокращает эффективный артериальный кровоток с дополнительной активацией вазоконстрикторных систем (7). В одном из исследований, распространенность гепаторенального с-ма у пациентов с СБП без введения альбумина составила 33%, и только 10% при введении альбумина. Кроме того, смертность была меньше у тех, кто получает альбумин (10%) против тех, кто не получает альбумин (29%). Несмотря на эти выводы, необходимо больше исследований для того, чтобы определить оптимальную дозу альбумина в этой ситуации. Другие плазменные заменители, такие как внутривенный гидроксиэтилкрахмал не являются эффективными с точки зрения предупреждения почечной недостаточности в условиях СБП. Другая стратегия использует для предотвращения гепаторенального синдрома ингибирование цитокинов, связанных с бактериальными продуктами, к примеру, фактор некроза опухоли-а (TNFa), или селективную деконтаминацию кишечника с целью уменьшения пагубного воздействия бактериальной транслокации на сердечно-сосудистую функцию. В одном исследовании пациентов с острыми алкогольными гепатитами, введением пентоксифиллина, анти-TNFa per os (400мг три раза/сут 1 месяц) было обнаружено снижение заболеваемости (8% - группf пентоксифиллина, по сравнению с 35% в плацебо) и смертности (24% в группе пентоксифиллина против 46% в плацебо) при гепаторенальном синдроме. Наконец, рандомизированное двойное слепое плацебоконтролируемое исследование применения норфлоксацина (доза 400 мг / сут) для селективной деконтаминации кишечника у пациентов с циррозом и высоким риском возникновения СБП и типа-1 гепаторенального синдрома, показало снижение заболеваемости СБП с развитием гепаторенального синдрома (14% против 28%), улучшение 6-месячной (81% против 64%) и долгосрочной выживаемости (70% против 61%) (9). В этом исследовании, положительный эффект норфлоксацина в предотвращении гепаторенального синдрома не был связан с воздействием препарата на предотвращение развития СБП. Дальнейшие исследования необходимы для дальнейшей оценки этих и других стратегий по профилактике гепаторенального синдрома при циррозе. Ведение пациентов. В лечении гепаторенального синдрома всегда должен приниматься во внимание тот момент, как оба типа различаются по времени течения и прогнозу. При типе 1 гепаторенального синдрома больные обязаны быть госпитализированы и быть под строгим контролем. Пациентам вводят плазму после того, как исключают другие причины возникновения почечной недостаточности. Больных с типом 2 гепаторенального с-ма можно вести как амбулаторных больных, если они не имеют осложнений. Учитывая, что пациенты часто недоедают, требуют диеты с ограничением натрия, диетолог должен также наблюдать за пациентом. Помимо обычных гематологических и биохимических анализов крови, все пациенты должны пройти диагностический парацентез для исключения СБП, исследование культуры крови осуществляется по правилам для других бактериальных инфекций. Введение диуретиков должно было прекращено, поскольку они могут ухудшить почечную недостаточность и электролитные нарушения. Наконец, вероятно, наиболее важным аспектом оказания помощи больным с гепаторенальным синдромом является выявление кандидатов на ортотопическую трансплантацию печени (OТП). У тех, которые являются кандидатами на ОТП, все усилия должны быть направлены на улучшение почечной функции в целях получения лучшего результата после трансплантации. Сейчас терапия для типа 1 HRS включает использование органных вазоконстрикторов, альбумина и TIPS. Резюме терапевтических вмешательств при гепаторенальном синдроме изложены в диаграмме 2. Фармакологическая терапия Наиболее важной задачей при терапии гепаторенального синдрома является ликвидация почечной недостаточности, с тем чтобы обеспечить успешный мост для ортотопической трансплантации печени с тем, чтобы уменьшить заболеваемость и уменьшить побочные эффекты посттрансплантационной медикаментозной терапии для достижения уровня выживаемости, аналогичной для пациентов без гепаторенального синдрома. Лица с гепаторенальным с-мом, которые получали терапию терлипресином и альбумином до трансплантации печени, имеют период после трансплантации и выживаемость аналогичную таковой у больных без гепаторенального синдрома, которым была проведена трансплантация печени. Системные вазоконстрикторы с введением плазмы в настоящее время наиболее распространенная форма оказания фармакологической терапии при гепаторенальном синдроме. Эти лекарства используются в сочетании с альбумином, потому что они противостоят интенсивной вазодилятации в органной циркуляции, подавляют вазоконстрикторные эндогенные факторы, ответственные за гепаторенальный синдром. Терапия вазоконстрикторами при гепаторенальном синдроме включает аналоги вазопрессина (терлипрессин) и агонисты альфа- адренорецепторов (мидодрин и норадреналин). Опубликовано много данных по использованию внутривенного терлипрессина. Альбумин был одновременно использован с этим вазоконстриктором как средство для повышения эффективного артериального объема крови, и, соответственно, для дальнейшего подавления вазоконстрикторных эндогенных факторов (например, ренин-ангиотензин-альдостероновой сис-мы , симпатической нервной с-мы), отвечающих за почечную вазоконстрикцию. Кроме того, введение альбумина за счет расширения V циркулирующей крови может увеличить диастолическое давление и сердечный выброс, который может привести к повышению эффективного V артериальной крови, что ведет к улучшению уровня клубочковой фильтрации. Терлипрессин Терлипрессин- синтетический аналог вазопрессина с более высоким уровнем безопасности и профилем эффективности, чем у вазопрессина и орнипрессина, который успешно использовался в прошлом десятилетии, рандомизированные и нерандомизированные исследования свидетельствуют о том, что он уменьшает почечную недостаточность при Типе 1 гепаторенального синдрома. В нерандомизированных исследованиях было показано, что использование терлипрессина и введения вв альбумина улучшает функцию почек примерно в 60-65% пациентов с типом 1 гепаторенального синдрома (6). Два последних многоцентровых рандомизированных контролируемых исследований показали, что ликвидация гепаторенального синдрома, согласно одним и тем же критериям, была достигнута в 34% и 44% пациентов, получающих терлипрессин и альбумин (10,11). В одном исследовании (Североамериканское исследование) 112 пациентов, больные были рандомизированны для получения терлипрессина (lмг/6ч) и альбумина или плацебо пока кровень креатинина снизился до <1,5 мг / дл в 2 измерениях через 48 часов или до 14 дней (10). Ликвидация гепаторенального синдрома была достигнута в 34% в группе терлипрессина против 13% - плацебо группа (р = 0.008). В целом выживаемость и свободная трансплантационная выживаемость были схожими между обеими группами. В другом исследовании (исследование TAHRS) 46 пациентов с циррозом и гепаторенальным синдромом были рандомизированны для получения терлипрессина (1 мг/4ч) и альбумина (доза 1 г/кг до 40 г / сут) (N = 23 ) или монотерапии альбумином (N = 23) в течение до 15 дней. Улучшение почечной функции имели место в 44% в группе терлипрессина по сравнению с 9% в группе монотерапии альбумином (р = 0.017). Независимыми прогностическими факторами ответа на терапию были: базовый объем мочи, сывороточный креатинин, количество лейкоцитов и назначенное лечение. Несмотря на то, что 3-месячная выживаемость не значительно отличалась между двумя группами, улучшение почечной функции было связанно с более продолжительной выживаемостью у респондеров по сравнению с нереспондерами. Независимыми прогностическими факторами 3-месячной выживаемости были: базовый показатель по MELD и ответ на терапию. Результаты этих двух исследований указывают на то, что терлипрессин и альбумин улучшают ф-цию почек у больных с гепаторенальным с-мом, но в процентном отношении ниже (34-44%), чем сообщалось ранее в нерандомизированных исследованиях (60-65%). Причина этого расхождения не ясна, но может быть связана отсутствием рандомизации и слепого контроля. Доза терлипрессина колеблется до 1 мг каждые 5-6 часов с поэтапным увеличением до дозы 1,5 мг каждые 5-6 часов каждые 3 дня , если значительное снижение уровня сыв. креатинина (> 25% уровня до лечения или > 1 мг / дл) не было отмечено в ходе каждого 3-дневныго срока. Рекомендуемая сут. доза альбумина - 1 г/кг до 30-40 г/ сут. В большинстве случаев улучшение почечной функции начинается на 5 - 6 день. Конечной точкой лечения является снижение сыв. креатинина в 1,5 мг/дл, в целом на это уходит от 1 до 2 недель. Повторения гепаторенального синдрома типа 1 после прекращения лечения (терлипрессин и альбумин) составляет от 5% до 15%. Повторный курс терлипрессина с альбумином, как правило, эффективно снижает уровень сыв. креатинина. Хотя терлипрессин имеет более лучший профиль безопасности, чем другие аналоги вазопрессина, побочные эффекты на ССС, в том числе ишемия миокарда, аритмии, ишемия кишечника или перегрузки системы кровообращения были зарегистрированы при применении терлипрессина. Таким образом, у лиц с гепаторенальным с-мом, которые принимают терлипрессин, следует внимательно проводить кардиологический мониторинг в идеале в палатах полу-интенсивной или интенсивной терапии, и при появлении нарушений в сердечно-сосудистой системе применение терлипрессина должно быть прекращено незамедлительно. Мидодрин, октретид и норадреналин. Использование мидодрина (агониста альфа-адренорецепторов) в комбинации с октретидом и альбумином также улучшает ф-цию почек у лицв с циррозом и гепаторенальным синдромом. Тем не менее, имеющиеся данные пока ограничены небольшим количеством исследований, в общей сложности менее 80 пациентов. В этих исследованиях было показано улучшение функции почек и уровня клубочковой фильтрации с супрессией ренина, альдостерона и норадреналина до нормального или почти нормального уровня в 80% случаев. Интересно, что другое исследование показало, что октретид является неэффективным при введении в качестве монотерапии. Непрерывное введение норадреналина (1-3 мг / час) в течение 5 дней в сочетании с вв введением альбумина привело к значительному улучшению почечной функции в небольшой группе пациентов с циррозом и гепаторенальным синдромом типа 1. Еще одно небольшое исследование показало, что норадреналин был эффективным и безопасным, как терлипрессин, у лиц с гепаторенальным с-мом. К сожалению, не хватает информации по этим терапевтическим схемам для гепаторенального синдрома и, несмотря на тот факт, что имеющиеся данные выглядят многообещающими, необходимы более крупные и контролируемые исследования для определения их роль в фармакологической терапии гепаторенального синдрома. Нефармакологическая терапия. Трансплантация печени. Метод является лечением выбора для лиц с гепаторенальным синдромом. Выживаемость пациентов с циррозом и гепаторенальным синдромом, которым была проведена трансплантация печени, составляет 60% в течение трех лет, хотя присутствие гепаторенального синдрома связано с ростом заболеваемости и ранней смертности после пересадки печени. В самом деле, больные с гепаторенальным с-мом, которым была проведена трансплантация, имеют больше осложнений, проводят большее количество дней в реанимационном отделении, и имеют более высокую смертность в условиях больницы, чем пациенты с трансплантацией печени без гепаторенального синдрома. Трансплантация печени для типа 1 гепаторенального синдрома ограничивается тем фактом, что многие больные умирают, не дожив до операции, поскольку имеют низкую выживаемость, а также из-за длительного время ожидания в большинстве центров. Таким образом, поскольку пациенты с Тип 1 гепаторенального синдрома имеют очень плохие прогнозы, данной группе больных должно быть уделено больше внимания для трансплантации печени. В связи с тем, что пациенты типа 1 гепаторенального синдрома имеют высокие баллы по MELD, использование шкалы MELD, как система для выделения пациентов для трансплантации печени, может сократить смертность в очереди ожидания и улучшить применение трансплантации печени у этих пациентов. По сути, использование шкалы MELD в Соединенных Штатах, поставило лиц с гепаторенальным синдромом на более высокий уровень приоритета для трансплантации печени в связи с тем, что креатинин является сильной переменной в математической модели. Кроме того, MELD шкала дает хорошую оценку прогноза у пациентов с типом 2 гепаторенального синдрома. С другой стороны, пациенты с типом 1 гепаторенального синдрома, ожидающие трансплантацию печени, проходят терапию гепаторенального синдрома, направленное на улучшение функции почек перед трансплантацией. В самом деле, исследование небольшого числа лиц с гепаторенальным синдромом относительно применения вазоконстрикторов до трансплантации печени показало, что лица с гепаторенальным синдромом, которые отреагировали на терапию, имели результаты после трансплантации, которые не отличались от таковых у пациентов с трансплантацией без гепаторенального синдрома. Использование комбинированной трансплантации печень-почки у лиц с гепаторенальным с-мом, как было сообщено, не улучшает общие результаты, полученные при трансплантации печени, повышает использование почек и, следовательно, не должна быть рекомендована. Трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS) Два неконтролируемых исследования свидетельствуют о том, что TIPS может улучшить функцию почек и ур-нь клубочковой фильтрации, а также снижает акт. ренин-ангиотензиновой системы и симпатической НС у пациентов с циррозом и типом 1 гепаторенального синдрома (13,14). Улучшение почечной функции после использования TIPS в одиночку идет медленно и является успешным примерно в 60% больных. Средняя выживаемость после TIPS у пациентов с типом 1 гепаторенального синдрома колеблется от двух до четырех месяцев. Исследования по оценке использования TIPS
Тэги: врач, гастроэнтерология, статья Рефрактерный асцит2012-09-21 15:25:00 Асцитическая жидкость должна быть исследована с целью исключения СБП, особенно у пациентов с признаками инфекции, абдоминальной болью, энцефалопатией или какими-либо необъяснимыми осложнениями цирроза. Количество нейтрофилов в асцитической жидкости больше, чем 250 клеток / мм3 является диагностическим критерием СБП. СБП и гепаторенальный синдром должны быть предотвращены при возможности. В случае цирроза должны быть ликвидированы прежде всего алкоголизм и вирусный гепатит. На самом деле, значительное улучшение функции печени при разрешении асцита можно наблюдать у некоторых пациентов после воздержания алкоголя или противовирусной терапии. Пациенты должны быть на диете с низким содержанием натрия (1200-1500 мг), поскольку было доказано, что это содействует ликвидации асцита и повторной задержке жидкости в брюшной полости. Применение диуретиков должно быть прекращено, если нет существенной экскреции натрия с мочой (<30 ммоль / сутки). Конкретные меры. В настоящее время к терапевтическим стратегиям для рефрактерного асцита относятся, главным образом, три процедуры: 1. Трансплантация печени 2. Парацентез 3. Трансъюгулярное внутрипеченочное порто-системное шунтирование (TIPS) Трансплантация печени. Любого пациента с циррозом и асцитом следует считать потенциальным кандидатом на трансплантацию печени. Рефрактерный асцит указывает на серьезное заболевание печени. У пациентов с рефрактерным асцитом, 5 - летняя выживаемость ниже 30% по сравнению с 80% после трансплантации печени. Момент, когда пациент должен быть причислен к категории на пересадку печени, в значительной степени зависит от местных факторов, в частности время для ожидания пересадки печени. Тем не менее, поскольку прогнозы у таких пациентов являются крайне неблагоприятными, трансплантация печени должна быть указана до развития осложнений. Парацентез. На сегодняшний день стандартом терапии для пациентов с рефрактерным асцитом в большинстве случаев является парацентез. Парацентез быстро ликвидирует растяжение брюшной полости, уменьшает боль и дискомфорт. Он может проводиться в амбулаторных условиях. Тем не менее, он не влияет на портальную гипертензию и механизмы накопления жидкости. Таким образом, наблюдается, как правило,повторение асцита. Кроме того, большой объем жидкости, удаленной при парацентезе, индуцирует изменения кровообращения и характеризуется заметным повышением альдостерона и активности ренина плазмы. Кровеносные дисфункции после удаления большого объема жидкости при парацентезе связаны с высоким риском гипонатриемии, гепаторенального синдрома и сокращения выживаемости. Такое ухудшение функции кровообращения встречается у 60-70% пациентов с парацентезом без введения адекватных объемов плазмы, у 30-40% пациентов с парацентезом и последующим введением адекватных объемов плазмы с синтетическими плазменными заменителями и только у 18% пациентов с парацентезом, введением адекватных объемов плазмы и альбумина. Распространенность сосудистой дисфункции также зависит от объема жидкости, который удаляется. Поэтому, рекомендуется проводить введение альбумина в тех случаях, когда объем удаляемой жидкости больше 5 литров (8г белка на литр).При парацентезе объемом менее 5 литров могут быть использованы синтетические заменители плазмы. Другие острые осложнения парацентеза имеют спорадический характер и крайне редки при надлежащем и тщательном выполнении процедуры. Трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS). TIPSработает в качестве портокавального шунта. TIPSпрепятствует формированию асцита путем снижения портального давления, подавляет эндогенную вазоконстрикторную систему, улучшает почечную перфузию и уровень гломерулярной фильтрации. Кроме того, TIPS вызывает декомпрессию органной и печеночной микроциркуляции, ведущие к уменьшению формирования лимфы. Показания к этой процедуре перечислены в таблице 2. Ряд экспериментальных неконтролируемых исследований предложили, что TIPS является эффективным в лечении рефрактерного асцита и гидроторакса у больных с циррозом. Были выполнены пять рандомизированных исследований с целью сравнения TIPS и парацентеза в лечении рефрактерного асцита. Все эти исследования ясно показали, что TIPS является более эффективным, чем парацентез в предотвращении повторения асцита даже в тех случаях, когда вливание альбумина происходит систематически и связанно с парацентезом. Однако, у пациентов с TIPS, как было установлено, имеется повышенный риск энцефалопатии. В большинстве случаев пациенты с энцефалопатией отвечают на медицинское лечение. Только некоторым пациентам с хронической энцефалопатией возникает необходимость уменьшения диаметра стента. Результаты в отношении выживаемости были противоречивые в различных сообщениях. Первое исследование, проведенное D Lebrec и др. в 1996 году, включало очень небольшое число пациентов и показало высокий уровень смертности в группе TIPS для пациентов класса C по Child. Два исследования показали улучшение выживаемости пациентов, которым проведено TIPS, а двум другим не удалось показать какие-либо различия между двумя группами. Пять мета-анализов были опубликованы. Первые четыре обнаружили тот же результат: TIPSявляется более эффективным в предотвращении повторения асцита, но риск энцефалопатии возрастает и выживаемость остается без изменений по сравнению с парацентезом, при котором эвакуируются большие объемы жидкости. В целом, можно при необходимости пролечить 2-3 пациентов TIPSвместо парацентеза для предотвращения одного эпизода асцита, в то время как эпизод энцефалопатии встречается у каждого 6 пациента, у которых использовался TIPS. Совсем недавно опубликован мета-анализ, выполненный F Salerno и др. включает 4 рандомизированных контролируемых исследований, объединяя 305 пациентов, и дает некоторые дополнительные данные, извлеченные из индивидуальных данных. Основная конечная точка этого мета-анализа - смерть от любой причины до пересадки печени (свободная трансплантационная выживаемость). Вероятность выживания трансплантата была лучше у пациентов с TIPS, чем в группе парацентеза: 63% и 52% в течении одного года , 49% и 35% в течении 2-х лет, соответственно. Параметры, связанные со смертностью, - более пожилой возраст, более высокий уровень билирубина, более низкая концентрация натрия в плазме. Связанные с печенью смерть и энцефалопатия, были также проанализированы в трех исследованиях. Общий риск осложнений портальной гипертензии был значительно выше в группе парацентеза (28%), чем в группе TIPS (15%). TIPSне излечивает печеночную недостаточность, а улучшение выживаемости может наблюдаться в результате уменьшения угрожающих жизни осложнений, таких как спонтанный бактериальный перитонит, гепаторенальный синдром или кровотечение из варикознорасширенных вен. Наконец, в этом мета-анализе было показано, что риск возникновения первого эпизода энцефалопатии или первого эпизода тяжелой энцефалопатии не отличается у двух групп. Вместе с тем, среднее количество эпизодов на одного пациента было увеличено в группе TIPS по сравнению с группой парацентеза. В настоящее время это основной недостаток TIPS. Тем не менее, следует отметить, что почти 40% пациентов, включенных в эти исследования, имели легкую энцефалопатию до начала процедуры. Лучший отбор больных может привести к снижению риска энцефалопатии после TIPS. Тэги: врач, гастроэнтерология, статья
Главная / Главные темы / Тэг «гастроэнтеролог»
|
Категория «Картинки»
Взлеты Топ 5
Падения Топ 5
Популярные за сутки
|
Загрузка...



